药品和复方药召回事件的分类和比较分析

微数生物
文献共享速递
Paper Sharing



摘 要
背景:确保药品的质量和安全是保护公众免受有害或潜在有害药物侵害的关键。尽管FDA每个财年都会报告召回产品的数量,并根据产品类型和召回分类对召回事件进行分类,但这些报告并未区分药品和复方药。
目的:本研究旨在根据召回原因对药品召回进行分类,然后比较制药企业和复方药生产企业之间差异的原因。
方法:所有公开的药品召回数据均于2021年1月24日从FDA data Dash-board网站下载。两名分析人员分别对召回公司、分配模式和召回原因进行了分类,第三名评审员复合所有的不一致之处。对整个样本的召回事件分类、分布和召回原因进行了描述性统计。独立性卡方检验用于根据工厂类型(制药企业和复方药生产企业)以及事件分类(I、II或III类)评估分类变量。仅对代表最严重召回的I级召回进行了分组分析。
结果:2012年6月8日至2021年1月24日,共召回12343种药品;6771份来自制药企业,5572份来自复方药企业。来自制药企业和复方药生产企业的大多数召回都是二级召回,产品被分发到多个州。无菌保证是复方药生产企业召回的主要原因,而产品质量是制药企业召回最频繁的原因。在召回分类中,制药企业和复方药生产企业之间的I类召回以及召回原因存在统计上的显著差异。
结论:在召回药品的原因、分销水平以及制药企业和复方药生产企业的产品类别方面存在统计学显著差异。

背 景
药物召回
FDA的药物评估和研究中心对非处方药(OTC)和处方药进行监管,以确保在美国有安全有效的药物。该法规包括在产品向公众销售前对药物的安全性、有效性和质量进行审查。保护公众对有缺陷或潜在有害产品的投诉是通过药品召回。药品召回是为了将产品从市场上移除而采取的行动,最常见的原因是安全问题或药品缺陷。FDA负责监督药品召回过程,审查公司的召回策略,并根据对其造成的风险对召回进行分类并评估召回的充分性。召回分为3类。I类召回是最严重的,当产品有合理的可能性会导致严重的不利于健康影响或死亡时发生。当产品可能导致暂时或医学上可逆的不利于健康后果,或严重不利于健康的可能性很小时,发生二级召回。三级召回是最不严重的,发生在产品不太可能对健康造成不良影响,但违反了FDA标签或制造法。尽管大多数召回是制造商或分销商自愿采取的行动,但也可以根据FDA的要求或授权发起召回;然而,这些召回通常是为紧急情况保留的,通常被归类为I类召回。
一旦公司决定发起召回,将向FDA提交信息,包括产品标识、移除或纠正原因、发现产品缺陷或可能缺陷的日期和情况、与缺陷或可能的缺陷相关的风险评估、生产的产品总量、预计将分发的产品总量、分发信息、召回沟通或拟定沟通、拟定的召回策略以及应联系的公司官员的联系信息。提交后,FDA召回信息将被放入每周的食品和药物局执法报告中,如果召回对健康造成严重危害或产品已被广泛分发,将发布公开通知。
配制药物(复方药物)
与非处方药和处方药不同,复方药物产品不接受FDA的安全性、疗效或质量审查。配制是指通过组合、混合或改变药物的成分,使药物符合个体患者的需要的过程。《联邦食品、药品和化妆品法案》包括两个章节,分别是503A和503B。根据第503A节的规定,在州特许药房、联邦机构或执业医师处进行配制。根据第503A节配制的产品在上市前无需获得FDA批准,无需贴上充分的使用说明标签,也无需遵守当前的良好生产规范(CGMP)。相反,美国药典(USP)规定需遵循它的要求进行配制。USP中有两个主要章节侧重于配制,<795>关于非无菌制剂的配制,<797>侧重于无菌制剂。这些章节包括配制指南,并描述了防止患者伤害的条件和实践,包括但不限于配制设施和设计、设备、培训、使用的组件、文件,以及超过使用日期(BUD)。根据第503B节,配制需要在FDA注册的外包方中进行。根据第503B节合成的产品在上市前也可免于获得FDA批准,并免于标签要求;然而,外包方需要遵循CGMP。尽管FDA有法定权力监管配制过程,但对在未在FDA注册的外包方进行的配制的主要监督是州药品管理局的责任,FDA应对投诉进行原因检查。注册后,FDA将对外包方的设施进行检查,随后采用基于风险的方法进行检查。配制在治疗患者方面发挥着重要作用;然而,由于缺乏综述,复方药物产品对患者构成潜在风险。由于制成品和复方制品之间的监管不同,药品被召回的原因可能因制成品和复方药品而异。此外,随着患者接受复方产品的频率增加,了解这些产品可能给公众带来的风险很重要。
确保药品供应链的质量和安全是保护公众免受有害或潜在有害药物危害的关键政策重点,其中药品召回起着重要作用。因此,重要的是要了解导致产品召回的原因,不仅要支持药品供应链,还要确保公众能够获得安全的药品。尽管FDA报告了每个财年召回产品的数量,并根据产品类型和召回分类对召回进行了分类,但这些报告并未区分药品和复方药。近年来,复方药的流行率有所上升,最近对商业索赔数据的分析发现,从2012年到2013年,受益人中复合药物的普及率增加了27.3%。同样,Office of the Inspector General 2016年的一份报告发现,从2006年到2015年,接受复方药的医疗保险受益人人数增加了281%,同期支出增加了625%。
表1 召回的七个原因的定义

--

结 果
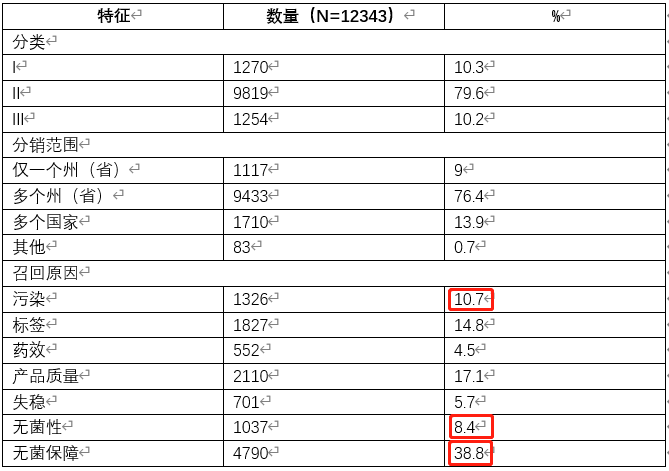
从2012年6月8日至2021年1月24日,1007家公司共发起2884件召回,涉及12343种药品。II类召回9819种产品排名第一;I类召回排名第二,召回1270种产品;III类召回最少,召回1254种产品。佛罗里达州是发起召回的公司最多的州,有1239家。
在召回的12343种药品中,6771种来自制药企业,5572种来自复方药生产企业。1117种产品仅分销给一个州,9433种产品分销给多个州,1710种产品分销到多个国家,83种产品由于提供的信息不完整而无法分类。4790件产品因无菌保证而召回,2110件产品由于产品质量而召回,1827件产品由于标签原因召回,1326件产品由于污染原因召回,1037件产品因为无菌原因召回,701件产品由于失稳召回,552件产品由于药效原因召回(参见表1)。
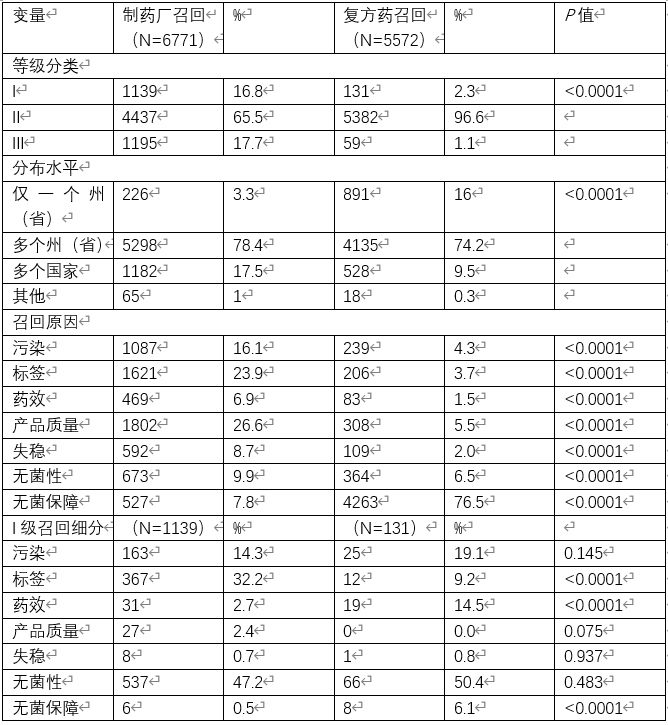
来自制药企业和复方药生产企业大多数召回均为二级召回,分别为5382次(96.6%)和4427次(65.5%),产品分布到多个州,分别为4135次(74.2%)和5298次(78.4%)。无菌保证是4263种产品(76.5%)的成分召回的主要原因,产品质量是制造商召回最频繁的原因(1802种产品,26.6%)。
制药企业和复方药生产企业之间的召回分类和分布水平存在统计学显著差异(P<0.0001)。制药企业和复方药生产企业之间的召回原因也存在统计显著差异(P<0.001)。进行分组分析以评估I级召回。在复方药生产企业有131起I类召回事件,制药企业有1139起。复方药生产企业和制药企业的大部分I类召回是由于无菌问题,分别为50.4%和47.2%(P=0.483);然而,与制药企业相比,复方药生产企业有更多与无菌保证相关的召回(P<0.0001)。复方药生产企业也有更多的I类召回原因是效力(P<.0001),而制药商有更多的原因是标签问题(P<0.001)。在污染、产品质量或稳定性故障方面没有统计学显著差异。参见表3。
表2 所有的召回事件特征分类
与召回分类相比,召回原因存在统计学显著差异。大多数I类召回是由于无菌问题,II类召回是因为无菌保证,III类召回是稳定性故障。参见表4。
表3 成分和制造商的分布、召回事件分类和召回原因
--

结 论
在召回原因、分销水平以及药品和复方药的产品类别方面存在统计学上的显著差异。在包括的制造药品中,大多数产品因产品质量问题而被召回,而无菌保证是复方药被召回的最常见原因。随着重点转向确保药品供应链的质量和安全,在制定保护公众健康免受潜在有害药物影响的解决方案时,必须将所有药品生产商,包括药品制造商和复方药制作商纳入讨论。
--

原文链接:
关于微数生物
杭州微数生物科技有限公司是一家专注于微生物基因组学研究和转化的科技型企业。公司研发团队博士和硕士学历占总人员90%以上,有近20年微生物基因组分析系统开发、基因鉴定和CRISPR快速检测的研发背景,承担了国家科技部重大专项子课题、浙江省重大专项、省部共建重大专项等项目。微生物基因鉴定方法获CNAS认可。秉承“数据驱动产业”的理念,目前已服务200+三甲医院、科研院所、制药企业,为客户提供专业的微生物基因数据解读方案和微生物基因检测产品,引领微生物组学进入产学研结合的多源异构大数据时代。

-
-
立即停用!或致失明甚至死亡!因微生物污染,FDA警告消费者不要购买或使用EzriCare人工泪液
立即停用!或致失明甚至死亡!因微生物污染,FDA警告消费者不要购买或使用EzriCare人工泪液
넶77 2023-02-13 -
生产“安全”的药物:通过洁净室来控制微生物
넶54 2023-02-13 -









